कोलॉइड विलयन क्या है ?
वास्तविक विलयन, कोलॉइडी विलयन और निलंबन के बीच भिन्नता
आप जानते है। कि पानी में शर्करा का विलयन समागं होता है, पर दूध में नहीं। दूध को ध्यान से देखने पर उसमें तेल की बूंदें तैरती दिखेगी। इसलिए, यघपि वह समांग लगता है पर वास्तव में वह विशमांग होता है। All प्रकार के विलयनों का स्वभाव विलेय कणों के आमाप पर निर्भर करता है। यदि आमाप 1 से 100 nm के बीच हो तो कोलॉइडी विलयन बनता है, जब विलेय कणों का आमाप 100 nm से अधिक हो तो वह निलंबन के Reseller में पाया जाता है। इस प्रकार कोलॉइडी विलयन वास्तविक विलयन और निलंबन के बीच की अवस्था होती है।
कोलॉइडी विलयन की प्रावस्थाएँ
कोलॉइडी विलयन विशमांग होते हैं और उनमें कम से कम दो प्रावस्थाएँ होती हैं परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम।
- परिक्षिप्त प्रावस्था: वह पदार्थ जो कम मात्रा में विघमान रहता है और इसके कण कोलॉइडी आमाप (1 से 100 nm) के होते हैं।
- परिक्षेपण माध्यम: यह वह माध्यम है जिसमें कोलॉइडी कण परिक्षिप्त रहते है। पानी में, गंधक कोलॉइडी विलयन में गंधक कण परिक्षिप्त प्रावस्था बनाते हैं और पानी परिक्षेपण माध्यम होता है।
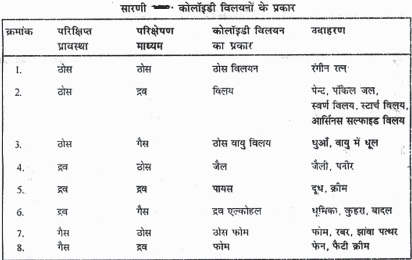
ये दो प्रावस्थाएँ : परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम, ठोस, द्रव अथवा गैस हो सकते हैं। इस प्रकार दो प्रावस्थाओं की भौतिक अवस्था के According कोलॉइडी विलयन विभिन्न प्रकार के हो सकते हैं। सारणी में विभिन्न प्रकार के कोलॉइडी विलयन और उनके उदाहरण दिए गए हैं।
ऊपर दिए गए विभिन्न प्रकार के कोलॉइडी विलयनों में विलय (द्रव में ठोस), जैल (ठोस में जल), और पायस (द्रव में द्रव) प्रमुख है। Historyनीय है कि यदि परिक्षेपण माध् यम जल हो तो विलेय को जल विलेय कहते हैं और यदि परिक्षेपण माध्यम ऐल्कोहॉल हो तो विलेय को ऐल्को विलेय कहते है।
कोलॉइडों का वर्गीकरण
कोलॉइडों विलयनों का विभिन्न प्रकार से वर्गीकरण Reseller जा सकता है-
- प्रावस्थाओं के बीच अन्योन्य क्रिया के आधार पर
- आण्विक आमाप के आधार पर
1. अन्योन्य क्रिया के आधार पर वर्गीकरण
परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम के बीच अन्योय क्रिया के आधार पर कोलॉइडी विलयनों को दो वर्गो में विभाजित Reseller जाता है।
- द्रवरागी कोलॉइड : द्रवरागी Word का Means है विलायक के प्रति बंधुता। गोंद, जिलेटिन, स्टार्च आदि पदार्थो को जब उचित विलायक के साथ मिलाया जाता है तो वे सीधे कोलॉइडी अवस्था में परिवर्तित होकर कोलॉइडी विलयन बना लेते है। इस प्रकार प्राप्त विलयों को द्रवरागी विलय कहते है। इन विलयों का Single महत्वपूर्ण लक्षण यह है कि यदि परिक्षिप्त प्रावस्था को परिक्षेपण माध्यम से पृथक कर दिया जाए तो उसमे परिक्षेपण माध्यम पुन: मिलाकर विलय को दुबारा बनाया जा सकता है, यही कारण है कि इन विलयों को उत्क्रमणीय विलय कहते है। ये विलय पर्याप्त स्थार्इ होते है।
- द्रवविरागी कोलॉइड : द्रव विरागी Word का Means है-विलायक के प्रति कम बंधुता ह और न जैसी धातुओं, उनके हाइड्रोक्साइडों अथवा सल्फाइडों आदि को जब परिक्षेपण माध्यम में मिलाया जाता है तो वे सीधे कोलॉइडी अवस्था में परिवर्तित नहीं होते हैं। उन्हें विशेष विधियों द्वारा बनाया जाता है। ये विलय शीघ्र अवक्षेपित हो जाते हैं और इस प्रकार बहुत स्थार्इ नहीं होते हैं। उन्हें कोलॉइडी Reseller में बने रहने के लिए स्थायीकारक की Need होती है। ये अनुत्क्रमणीय विलय होते हैं, क्योंकि अवक्षेपित होने पर ये विलायक के साथ मिलकर कोलॉइडी विलयन नहीं बनाते हैं। यदि परिक्षेपण माध्यम पानी हो तो उसे जलविरागी कोलॉइड कहते हैं।
(2) आण्विक आमाप के आधार पर वर्गीकरण
आण्विक आमाप के आधार पर कोलॉइडों का वर्गीकरण इस प्रकार है: –
- बृहदाणुक कोलॉइड : इस प्रकार के कोलॉइड में परिक्षिप्त प्रावस्था के कणों का आमाप कोलॉइड कणों के आमाप के बराबर बड़ा होता है। (यानि 100 nm) प्रकृतिक वृहदाणुक कोलॉइडों के उदाहरण हैं : स्टार्च, सेल्यूलोस, प्रोटीन आदि।
- बहु अणुक कोलॉइड : इसमें प्रत्येक परमाणु कोलॉइड के आमाप का नहीं होता पर वे आपस में पुंज बनाकर (जुड़कर) कोलॉइड़ो के नाप के अणु बनाते है। उदाहरणार्थ : सल्फर विलय में अणुओं के पुंज कोलॉइडों के नाप के होते हैं।
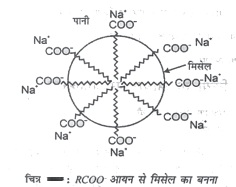
- संघटित कोलॉइड : ये पदार्थ कम सांद्रण में सामान्य विघुत अपघट्यों की तरह कार्य करते है, परन्तु अधिक सांद्रण में संघटित होकर मिसेल बनाते हैं जो कि कोलॉइड विलयन की तरह कार्य करते है। साबुन इसका उदाहरण है। साबुन लम्बी श्रृंखला वाले वसीय अम्ल R COONa का सोडियम लवण है। पानी में डालने पर साबुन RCOO- और छंदेता है। ये RCOO- आयन मलै के कण के चारों ओर संघटित होकर मिसेल बनाते है, इसे चित्र में दिखया गया है।
कोलॉइडी विलयनों का विरचन
जैसा First बताया जा चुका है द्रवरागी विलय बनाने के लिए पदार्थो को सीधे परिक्षेपण माध्यम के साथ मिलाया जाता है। उदाहरण के लिए स्टार्च, जिलेटिन, गोंद आदि के कोलॉइडी विलयन बनाने के लिए उन्हें केवल गर्म पानी पें घोला जाता है। उसी प्रकार सेलूलोस नाइट्रेट का कोलॉइडी विलय बनाने के लिए उसे ऐल्कोहॉल में घोला जाता है। प्राप्त विलयन को कोलोडियन कहते है। किन्तु द्रवविरागी कोलॉइडों को प्रत्यक्ष विधि द्वारा नहीं बनाया जा सकता है। उसे बनाने के लिए दो प्रकार की विधियाँ काम में लार्इ जाती हैं। ये है: –
- भौतिक विधि
- रासायनिक विधि
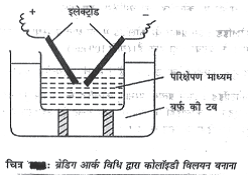
(i) भैतिक विधि : ब्रेडिग आर्क विधि
इस विधि का इस्तेमाल स्वर्ण, रजत, प्लेटिनम आदि धातुओं के कोलॉइडी विलयनों को बनाने के लिए Reseller जाता है (चित्र )।
इसमें पानी के पात्र में रखे दो धात्विक इलेक्ट्रोडों के बीच विघुत आर्क आरम्भ Reseller जाता है। आर्क की उच्च ऊश्मा धातु को वाष्प में परिवर्तित कर देती है। यह वाष्प ठंडे जल में शीघ्र संघनित हो जाती है। इसके फलस्वReseller कोलॉइडी आमाप के कण बन जाते है। इसे स्वर्ण विलय कहा जाता है।
पेप्टाइजीकरण: ताजा बने अवक्षेप में उपयुक्त विघुत अपघट्य मिला कर उसे कोलॉइड में बदलने के प्रक्रम को पेप्टाइजीकरण कहते है। उदाहरणार्थ, फेरिक हाइड्रॉक्साइड के अवक्षेप में फेरिक क्लोरॉइड मिलाने पर फेरिक हाइड्रॉक्साइड भूरे लाल रंग की कोलॉइडी विलयन में बदल जाता है। ऐसा अवक्षेप द्वारा विद्युत अपघ्य के धनायन के अधिशोषण के कारण होता है। Fe(OH)3 में FeCl3 डालने पर, Fe(OH)3 के कण FeCl3 के Fe3+ आयनों को अवशोषित कर लेते हैं। अत: Fe(OH)3 के कण धनावेशित हो जाते हैं और वे Single Second को प्रतिकर्षित करके कोलॉइडी विलयन बनाते हैं।
(ii) रासायनिक विधि : आक्सीकरण द्वारा :
गंधक विलय प्राप्त करने के लिए H2S गैस का HNO3 अथवा Br2 जल आदि ऑक्सीकारक विलयन में बुदबुदन Reseller जाता है। अभिक्रिया इस प्रकार होगी :
Br2 + H2S
_
S+2HBr 2 HNO3 + H2S
2 H2O + 2NO2 + S
रासायनिक विधि द्वारा Fe(OH)3 विलय, As2S3 विलय भी बनाए जा सकते हैं।
कोलॉइडी विलयनों का शोधन
जब कोलॉइडी विलयन बनाया जाता है तो बहुधा उसमें विघुत अपघट्य अपद्रव्य के Reseller में मौजूद रहता है, जो उसे अस्थायीकृत कर देता है। अत: कोलॉइडी विलयन के शोधन के लिए निम्नलिखित विधियों का उपयोग Reseller जाता है:-
- अपोहन (Dialysis)
- विघुत अपोहन (Electric Dialysis)
अपोहन:
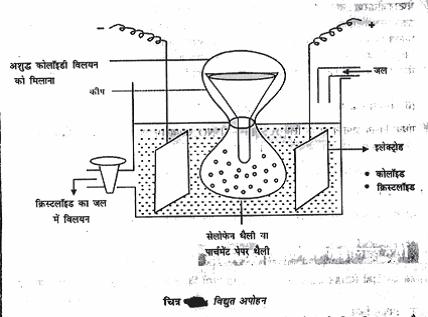
अपोहन का प्रक्रम इस तथ्य पर आधारित है कि पार्चमेंट पत्र या सेलोफेन झिल्ली में से कोलॉइडी कण नहीं निकल पाते है। लेकिन विघुत अपघट्य के आयन निकल सकते है। कोलॉइडी विलयन को Single डायलसिस (सेलोफेन) थैली में लेकर स्वच्छ जल से भरे पात्र में लटका दिया जाता है। अपद्रव्य धीरे-धीरे बाहर विसरित हो जाता है और थैली में शुद्ध कोलॉइडी विलयन रह जाता है (चित्र) विसरण द्वारा कोलॉइडी कणों को अपद्रव्यों से उपयुक्त झिल्ली से अलग करने के प्रक्रम को अपोहन कहते हैं।
विघुत अपोहन :
अपोहन प्रक्रम में विघुत के उपयोग से प्रक्रम की दर बढ़ार्इ जा सकती है। जब इलेक्ट्रोड़ों में विघुत प्रवाह की जाती है तो अपद्रव्य के आयन विपरीत आवेश वाले इलेक्ट्रोड की ओर तीव्र गति से विसरित होते है। विघुत प्रवाह की उपस्थिति में किए गए अपोहन को विघुत अपोहन कहते हैं। अपोहन का सबसे महत्वपूर्ण उपयोग कृत्रिम वृक्क मशीनों में रूधिर के शोधन के लिए Reseller जाता है। अपोहन झिल्ली में से आयन आदि छोटे कण निकल जाते हैं किन्तु हिमोग्लोबिन आदि कोलॉइडी आमाप के कण झिल्ली में से नहीं निकल पाते हैं।
कोलॉइडों के गुणधर्म
कोलॉइडों के गुणधर्मो की नीचे Discussion की गर्इ है:-
- विशमांग लक्षण : कोलॉइडी कण अपने ही सीमा पृष्ठों में रहते है। जो उन्हें परिक्षेपण माध्यम से पृथक करते है। इस प्रकार कोलॉइडी तंत्र दो प्रावस्थाओं का विशमांग मिश्रण होता है। ये दो प्रावस्थाएँ है: (क) परिक्षिप्त प्रावस्था (ख) परिक्षेपण माध्यम
- ब्राउनी गति : ब्राउनी गति नाम इसके आविष्कारक रॉबर्ट ब्राउन (वनस्पतिज्ञ) के कारण पड़ा। कोलॉइडी कणों की सतं त और अनियमित टेढ़ी-मेढ़ी गति को ब्राउनी गति उत्पन्न होती है। विभिन्न दिशाओं से लगने वाले बल असमान होते हैं इसलिए कणों की गति टेढ़ी मेढ़ी होती है। विलायक के अणुओं की कोलॉइडी कणों के साथ टक्कर से ब्राउनी गति उत्पन्न होती है।
- टिन्डल प्रभाव : 1869 में टिन्डल ने प्रेक्षण Reseller कि यदि कोलॉइडी विलयन में प्रकाश की तीव्र किरण पुंज प्रविष्ट की जाए तो प्रकाश-पथ प्रदीप्त हो जाता है। इस परिघटना को टिन्डल प्रभाव कहते है। यह परिघटना कोलॉइडी कणों द्वारा प्रकाश के प्रकीर्णन से होती है । जब Ultra site की किरणों किसी रेखाछिद्र से अंधेरे कमरे में प्रवेश करती हैं तो यही प्रभाव दृष्टिगोचर होता है। यह हवा के धूल के कणों द्वारा प्रकाश के प्रकीर्णन से होता है।
- वैघुत गुणधर्म : कोलॉइडी विलयन के कण विघुत आवेशित होते है। All कणों में धन अथवा ऋण Singleसमान आवेश होता है। परिक्षेपण माध्यम का समान और विपरीत आवेश होता है, इसलिए कोलॉइडी कण Single Second का प्रतिकर्शण करते है और Singleत्र हाके र नीचे नहीं बैठते हैं। उदाहरण के लिए आसेनियस सल्फाइड विलय, स्वर्ण विलय, रजत विलय आदि में ऋण आवेशित कोलॉइडी कण होते हैं जबकि फेरिक हाइड्रॉक्साइड, ऐल्युमिनियम हाइड्राक्साइड आदि में धन आवेशित कोलॉइडी कण होते है। कोलाइडी कणों के आवेशित होने के अनेक कारण है।
- कोलॉइडी कणों द्वारा धनायनों अथवा ऋणायनों का अधिषोषण
- मिसेल आवेशित होते हैं
- कोलॉइडों के विरचन के दौरान, मुख्यता ब्रेडिग आर्क विधि में कोलॉइड कण इलेक्ट्रॉनों को ग्रहण कर आवेशित हो जाते है। कोलॉइडी कणों पर आवेश की उपस्थिति को वैघुत कण संचलन प्रक्रम द्वारा दिखाया जा सकता है। वैघुत कण संचलन प्रक्रम में कोलॉइडी कण विघुत प्रवाह के प्रभाव से कैथोड अथवा एनोड की तरफ गतिशील होते हैं।
कोलॉइडी विलयन के अनुप्रयोग
कोलॉइडों की हमारे जीवन में महत्वपूर्ण भूमिका है। उनके कुछ अनुप्रयोगों की यहाँ Discussion की गर्इ है।
- मल व्यवस्था: धूल, हवा आदि के कोलॉइडी कणों में विघुत आवेश होता है। जब मल को उच्च विभव पर रखी धातु की प्लेटों के बीच प्रवाहित Reseller जाता है तो कोलॉइडी कण विपरीत आवेशित इंलेक्ट्रोड की ओर जाते हैं और वहाँ अवक्षेपित हो जाता है। इससे मल-जल का शोधन हो जाता है।
- कुओं के पानी का शोधन: जब पंकिल जल में फिटकरी मिलार्इ जाती है तो कोलॉइड के ऋणा आवेशित कण फिटकरी के AL3 आयनों द्वारा उदासीन हो जाते है। इस प्रकार पंक कण नीचे बैठ जाते है और पानी को छान कर इस्तेमाल Reseller जा सकता है।
- धूम्र अवक्षेपण: धूम्र कण वास्तव में हवा में कार्बन के विघतु आवेशित कोलॉइडी कण होते है। इस कार्बन का अवक्षेण कॉट्रेल अवक्षेपण द्वारा Reseller जाता है। चिमनी से निकलने वाले धुएँ को Single कक्ष में प्रविष्ट कराया जाता है। कक्ष में अनेक धातु प्लेटें Single धातु के तार से जुड़ी रहती है। यह तार उच्च विभव स्त्रोत से जुडा़ रहता है । धुएँ के आवेशित कण विपरीत आवेश वाले इलेक्ट्रोड की ओर आकृष्ट होकर अवक्षेपित हो जाते है। और गरम स्वच्छ वायु बाहर निकल जाती है।
- फोटोग्राफी : जिलेटिन में सिल्वर ब्रोमाइड के कोलॉइडी विलयन को काँच की प्लेंटो अथवा सेलुलाइड फिल्मों पर प्रयुक्त Reseller जाता है। इस प्रकार फोटोग्राफी में प्रयोग होनेवाली सुग्राही फिल्में प्राप्त होती है।
- रूधिर आतंचन : रूधिर, कोलॉइडी विलयन है जो ऋण आवेशित होता है। Fecl3 विलयन प्रयुक्त करने पर रूधिर का बहना बंद हो जाता है और रूधिर आतंचन हो जाता है। इसका कारण यह है कि Fe3+ आयन रूधिर के कोलॉइडी कणों के आवेश को उदासीन कर देते हैं जिससे आतंचन हो जाता है।
- रबर पट्टन : लेटेक्स, ऋण आवेशित रबर कणों का कोलॉइडी विलयन होता है। जिस वस्तु को रबर पट्टन करना हो उसे रबर पटट्न बाथ में एनोड बनाया जाता है। ऋण आवेशित रबर कण एनोड की ओर जाते हैं और उस पर निक्षेपित हो जाते है।
- आकाश का नीला रंग : क्या आपने कभी सोचा कि आकाश का रंग नीला क्यों होता है। इसका कारण यह है कि आकाश में तैरने वाले कोलॉइडी धूल कण नीले प्रकाश का प्रकीर्णन करते है। जिससे आकाश का रगं नीला दिखार्इ देता है। यदि आकाश में कोलॉइड कण न होते तो पूरा आकाश अंधकारपूर्ण लगता ।
पायस और जैल
पायस वे कोलॉइड विलयन होते हैं जिनमें परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम दोनों ही दव्र होते है। दोनों द्रव Single Second में अमिश्रणीय होते है, क्योंकि मिश्रणीय होने पर वे वास्तविक विलयन बना देगे । पायस दो प्रकार के होते है:
- पानी में तेल का पायस: यहाँ परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम पानी होता है। इसका उदाहरण दूध है। क्योकि दूध में द्रव वसा पानी में परिक्षिप्त होती है। इसका दूसरा उदाहरण चेहरे पर लगाने वाली क्रीम है।
- तेल में पानी : इसमें परिक्षिप्त प्रावस्था पानी और परिक्षेपण माध्यम तेल होता है। मक्खन, कॉड लिवर तेल, कोल्ड क्रीम आदि इसके उदाहरण है। रखने पर अमिश्रणीय होने के कारण पायस के दोनो द्रव यानि तेल और पानी अलग हो जाते हैं। इसलिए पयास को स्थार्इ बनाने के लिए इसमें पायसीकरण मिलाए जाते हैं। साबुन Single उपयोगी पायसीकरण है। पायसीकरण की उपस्थिति में पायस बनने के प्रक्रम को पायसीकरण कहते हैं। पायसीकरण कैसे कार्य करता है? पायसीकरण तेल और पानी के अंतरापृष्ठ पर सांद्रित होकर उन्हे बांध देता है।
पायस के अनुप्रयोग
पायस हमारे दैनिक जीवन में महत्वपूर्ण भूमिका निभाते है। कुछ अनुप्रयोग नीचे दिए जा रहे है:
- कपड़ों और शरीर पर से मैल धोने की साबुन और संश्लेशित अपमार्जक की प्रक्रिया, तेल और पानी के पायस बनने पर ही आधारित है।
- दूध, पानी और वसा का पायस हैं। मक्खन और क्रीम भी पायस है।
- विभिन्न प्रकार की चेहरे की क्रीम और लोशन भी पायस है।
- कॉड लिवर तेल जैसी तलीय औशधि जल्दी और बेहतर अवशोषण के लिए पायस के Reseller में दी जाती है। कुछ मरहम भी पायसीकरण द्वारा होता है।
- आंतों में वसा का पायन भी पायसीकरण द्वारा होता है।
- सल्फाइड अयस्क के शोधन के लिए प्रयुक्त फेन प्लवन प्रक्रम में उसका तेल का पायस के साथ उपचा Reseller जाता है। मिश्रण को संपीडित वायु से प्रक्षेपित करने पर अयस्क कण पृष्ठ पर आ जाते हैं, तब उन्हें अलग कर लिया जाता है।
जैल –
जिन कोलॉइडों में परिक्षिप्त प्रावस्था द्रव और परिक्षेपण माध्यम ठोस होता है उन्हें जैल कहते है। पनीर, जैल, बूट, पॉलिश, जैल के उदाहरण है। अधिकतर उपयोग होनेवाले जैल जलरागी कोलॉइडी विलयन होते है, जिनका तनु विलयन उचित परिस्थितियों में लचीले अर्धठोस पदार्थ में बदल जाता है। उदाहरण के लिए जिलेटिन का पानी में 5 प्रतिशत जलीय विलयन ठंडा करने पर जैली का ब्लाक बन जाता है। रखने पर जैल उसमें उपस्थित कुछ द्रव खो देते हैं और सिकुड जाते है। इसे संकोच पार्थक्य या रखने पर जमना कहते है।
जैल दो प्रकार के होते है – लचीले जैल और अलचीले जैल।
लचीले जलै उत्क्रमणीय होते है। पानी खोने पर जैसे वे जमते है पानी मिलाने पर वे वापिस मूल अवस्था में आ जाते है। अलचीले जैल अनुत्क्रमणीय होते है। जैल कर्इ प्रकार से उपयोग में आते है। सिलिका, पनीर, जैली, बूट पॉलिश, दही, काफी उपयोग होनेवाले जैल है। ठोस एल्कोल र्इधन, ऐल्कोहल का कैल्सियम एसिटेट में जैल है।